Conociendo los métodos alternativos In Vitro e In Silico

Los avances científicos han permitido el desarrollo de Nuevas Metodologías Alternativas (NAMs), las cuales ofrecen resultados más precisos y éticos sin necesidad de utilizar animales. Dentro de estas metodologías, destacan los modelos in vitro e in silico, los cuales han sido validados por organismos como la Organización para la Cooperación y el Desarrollo Económico (OECD) y la Administración de Alimentos y Medicamentos (FDA, en sus siglas en inglés). Estos enfoques permiten evaluar toxicidad, farmacocinética y seguridad de compuestos con mayor relevancia para la biología humana.
El desarrollo de NAMs está impulsado por la creciente preocupación sobre la sostenibilidad de los enfoques tradicionales basados en animales y la necesidad de métodos de prueba de toxicidad más confiables y eficientes. Sin embargo, acorde a otros expertos en la materia, para que un método alternativo sea validado y aceptado por la comunidad científica y regulatoria, debe someterse primero a un proceso de validación muy estricto.
Para ello, la OECD establece guías y lineamientos específicos que determinan los criterios que deben cumplir estos métodos. Esta validación incluye la reproducibilidad del método, ya que debe ofrecer resultados consistentes en diferentes laboratorios, la relevancia biológica para demostrar su capacidad de predecir efectos en humanos, y la comparabilidad de los resultados, que deben ser equivalentes o mejores a los obtenidos de estudios hechos con modelos animales.
Algunos ejemplos de NAMs validados por la OECD incluyen el Reconstructed Human Epidermis Test (2021), para evaluar corrosión e irritación cutánea, y el h-CLAT (2024), para evaluar la sensibilización cutánea que podrían causar ciertas sustancias químicas desconocidas o no clasificadas. Estos métodos han sido adoptados por agencias regulatorias en Europa y EE.UU, facilitando su integración en la industria y su adaptación a diferentes laboratorios.
Aceptación por la Comunidad Científica y Animalista
La comunidad científica ha mostrado un creciente interés en los NAMs sobre todo en el campo de la toxicología debido a su capacidad para generar datos más relevantes para la biología humana, con agencias implementando flexibilidad en sus marcos para permitir y fomentar su uso. Instituciones como el National Toxicology Program (NTP) y el European Centre for the Validation of Alternative Methods (EURL ECVAM) han impulsado el desarrollo de estas técnicas. Además, organismos como el Comité de Coordinación Interagencial sobre la Validación de Métodos Alternativos (ICCVAM, en sus siglas en inglés) han trabajado en la estandarización de estos métodos a nivel regulatorio.
Por otro lado, la comunidad animalista respalda fuertemente la adopción de estos métodos alternativos como una solución para erradicar la experimentación animal de forma progresiva pero legal. Organizaciones como Cruelty Free International, PETA Science Consortium, y Te Protejo han promovido iniciativas para acelerar la transición hacia el testeo libre de animales, presionando a legisladores y empresas para su implementación, como lo hizo Chile el año 2024 al prohibir la producción y venta de cosméticos testeados en animales, marcando un precedente importante en cuanto al avance de otras normas y leyes que podrían eliminar estas prácticas en campos biomédicos, agrícolas y diversas áreas de la ciencia.
Diferencias entre Métodos In Vitro e In Silico
Estos métodos, incluidas las técnicas in vitro e in silico, ofrecen beneficios notorios para el bienestar animal, la salud pública y la economía, ahorrando recursos no solo de infraestructuras sino también en la mantención de animales en bioterios adecuados y en costos de capacitación para el personal que manipula y monitorea a estos animales. Sin embargo, aunque representan estrategias complementarias en la evaluación de seguridad de compuestos, tienen diferencias claves en cuanto a su desarrollo, aplicación, replicación y validación.
Modelos In Vitro
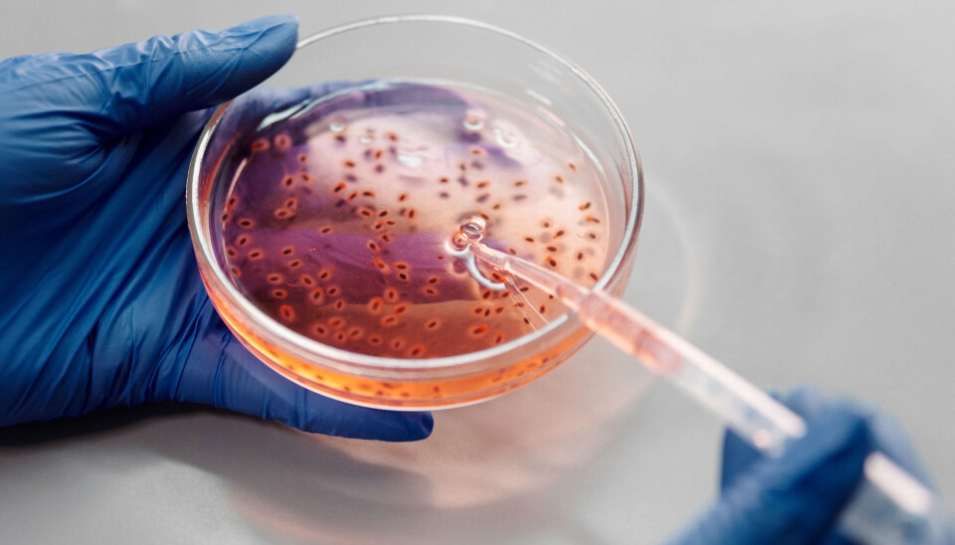
Los métodos in vitro se basan en el uso de cultivos celulares para estudiar respuestas biológicas ante sustancias químicas o no conocidas en condiciones controladas de laboratorio. Permiten evaluar citotoxicidad, genotoxicidad, inflamación, eficacia terapéutica y mecanismos moleculares específicos, sin recurrir a modelos de animales vivos.
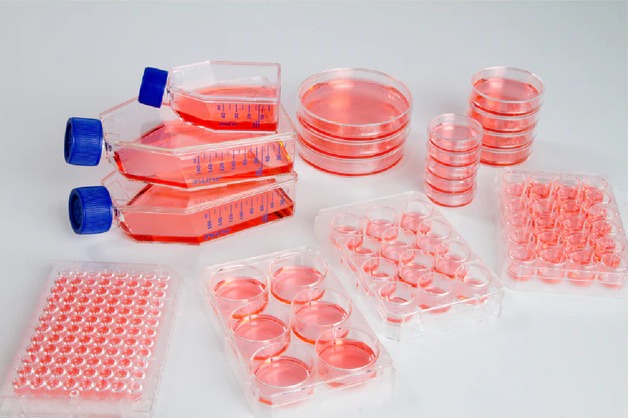
Una de sus principales ventajas es que los resultados obtenidos, utilizando células humanas, suelen ser más representativos de la biología humana que aquellos obtenidos en modelos animales. No obstante, su limitación radica en la ausencia de factores sistémicos como metabolismo, biodistribución y respuestas inmunológicas complejas, lo que dificulta la extrapolación de los resultados a nivel orgánico e in vivo.

Un ejemplo destacado es el Reconstructed Human Cornea-like Epithelium, un modelo tridimensional que permite evaluar irritación ocular sin necesidad de usar conejos. Estos modelos han sido ampliamente adoptados en toxicología cutánea, farmacología, oncología y neurociencias, demostrando su eficacia en la predicción de respuestas humanas.

Otros avances incluyen líneas celulares, que se utilizan ampliamente en ensayos de toxicidad, biocompatibilidad y respuesta a fármacos, ya que permiten analizar procesos celulares específicos, como proliferación, apoptosis y estrés oxidativo. Sin embargo, los modelos 2D tradicionales presentan limitaciones en cuanto a la arquitectura y comunicación celular, lo que ha impulsado el desarrollo de modelos tridimensionales (3D).
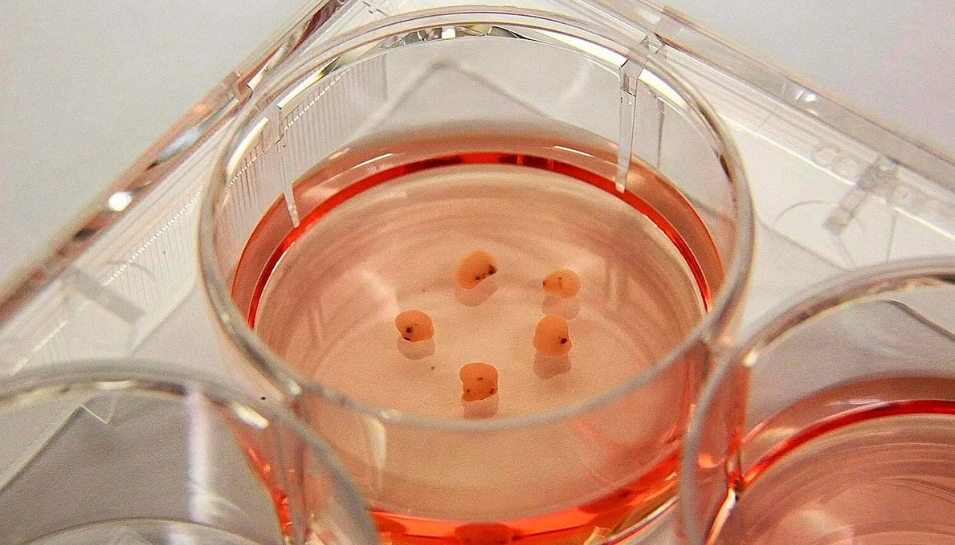
Estos mejoran la replicación de estructuras biológicas al imitar la organización y la interacción celular natural, lo que los hace más representativos de la fisiología in vivo. Dentro de estos, los organoides destacan por ser estructuras 3D derivadas de células madre, capaces de autoorganizarse y reproducir características funcionales de órganos específicos, como el intestino, el hígado, los riñones y el cerebro. Gracias a su complejidad, los organoides han revolucionado la investigación biomédica al permitir estudios avanzados sobre desarrollo, enfermedades y respuestas terapéuticas, superando muchas de las limitaciones de los modelos convencionales.
Modelos In Silico
La tecnología in silico utiliza métodos computacionales para predecir la toxicidad química, ofreciendo una alternativa más rápida y rentable a las pruebas con animales. Estos métodos emplean varias técnicas de modelado, incluidas las relaciones cuantitativas estructura-actividad (QSAR) y el cribado virtual, para analizar grandes volúmenes de datos. La principal ventaja de los enfoques in silico es su capacidad para evaluar rápidamente numerosos compuestos, lo que reduce el tiempo y los costos de la investigación.

Sin embargo, estos métodos enfrentan desafíos, como la necesidad de datos previos confiables para alimentar modelos predictivos y la complejidad de equilibrar la interpretabilidad del modelo con la previsibilidad. A pesar de estas limitaciones, la toxicología in silico está ganando importancia en contextos regulatorios, particularmente a la luz de la legislación europea REACH, que tiene como objetivo minimizar las pruebas con animales. Además, a medida que avanza el campo, se requieren conocimientos toxicológicos cada vez más sofisticados para desarrollar e interpretar estos modelos computacionales de manera efectiva.
Un ejemplo de este enfoque es el OECD QSAR Toolbox, una herramienta que permite predecir la toxicidad de sustancias químicas mediante modelos matemáticos basados en datos experimentales previos. Estos métodos tienen aplicaciones clave en farmacocinética, predicción de interacciones fármaco-receptor y evaluación de riesgos ambientales, proporcionando información valiosa para la toma de decisiones regulatorias y de seguridad.

Otros avances in silico incluyen:
-
Organ-on-a-Chip: Microdispositivos que integran células humanas en un entorno microfluídico, simulando la fisiología de órganos completos.

-
Sistemas multifluidos: Plataformas avanzadas que combinan múltiples órganos en chip para simular interacciones sistémicas dentro del cuerpo humano.
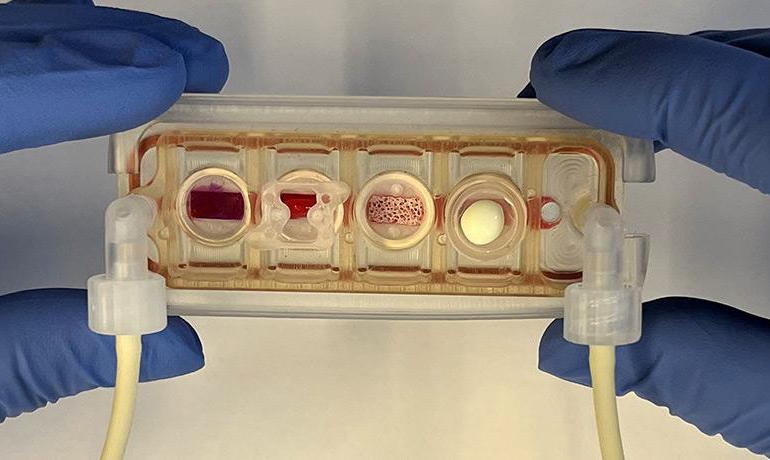
Promoviendo una Ciencia Sin Animales
Los NAMs representan una revolución en la investigación biomédica y toxicológica, ofreciendo soluciones más precisas, reproducibles y éticas. La validación de estos métodos por parte de organismos como la OECD y la FDA ha permitido su adopción en diversas industrias, demostrando que es posible eliminar la experimentación animal sin comprometer la calidad de los datos obtenidos.
Es crucial que científicos, reguladores y empresas colaboren en la implementación de estas alternativas, promoviendo una investigación responsable y alineada con el bienestar animal. Con el avance de la tecnología, la transición hacia una ciencia libre de animales es no solo viable, sino también una necesidad para el progreso científico y la bioética global.
Bibliografía
-
Nutrition, C. for F. S. and A. (2022). New Approach Methods (NAMs). FDA. https://www.fda.gov/food/toxicology-research/new-approach-methods-nams
-
OECD (2005), Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessment, OECD Series on Testing and Assessment, No. 34, OECD Publishing, Paris, https://doi.org/10.1787/e1f1244b-en.
-
OECD (2019), Test No. 431: In vitro skin corrosion: reconstructed human epidermis (RHE) test method, OECD Guidelines for the Testing of Chemicals, Section 4, OECD Publishing, Paris, https://doi.org/10.1787/9789264264618-en.
-
OECD (2021), Test No. 439: In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method, OECD Guidelines for the Testing of Chemicals, Section 4, OECD Publishing, Paris, https://doi.org/10.1787/9789264242845-en.
-
OECD (2024), Test No. 442E: In Vitro Skin Sensitisation: In Vitro Skin Sensitisation assays addressing the Key Event on activation of dendritic cells on the Adverse Outcome Pathway for Skin Sensitisation, OECD Guidelines for the Testing of Chemicals, Section 4, OECD Publishing, Paris, https://doi.org/10.1787/9789264264359-en.
-
Stucki, A. O., Barton-Maclaren, T. S., Bhuller, Y., Henriquez, J. E., Henry, T. R., Hirn, C., Miller-Holt, J., Nagy, E. G., Perron, M. M., Ratzlaff, D. E., Stedeford, T. J., & Clippinger, A. J. (2022). Use of new approach methodologies (NAMs) to meet regulatory requirements for the assessment of industrial chemicals and pesticides for effects on human health. Frontiers in Toxicology, 4. https://doi.org/10.3389/ftox.2022.964553
-
Stokes, W. S., Schechtman, L. M., & Hill, R. N. (2002). The Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM): A Review of the ICCVAM Test Method Evaluation Process and Current International Collaborations with the European Centre for the Validation of Alternative Methods (ECVAM). Alternatives to Laboratory Animals, 30(2_suppl), 23–32. https://doi.org/10.1177/026119290203002s04
-
Casey, W., Jacobs, A., Maull, E., Matheson, J., Clarke, C., & Lowit, A. (2015). A new path forward: the Interagency Coordinating Committee on the Validation of Alternative Methods (ICCVAM) and National Toxicology Program's Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM). Journal of the American Association for Laboratory Animal Science : JAALAS, 54(2), 170–173. https://pubmed.ncbi.nlm.nih.gov/25836963/
-
(2024). Biblioteca del Congreso Nacional | Ley 21.646 para prohibir la experimentación en animales en la elaboración de productos cosméticos y la venta, comercialización, importación e introducción en el mercado nacional de dichos productos cuando han sido testeados en animales. Www.bcn.cl/Leychile. https://www.bcn.cl/leychile/navegar?idNorma=1200504
-
Li, M., Gong, J., Gao, L., Zou, T., Kang, J., & Xu, H. (2022). Advanced human developmental toxicity and teratogenicity assessment using human organoid models. Ecotoxicology and environmental safety, 235, 113429. https://doi.org/10.1016/j.ecoenv.2022.113429
-
Fischer, I., Milton, C., & Wallace, H. (2020). Toxicity testing is evolving! Toxicology Research, 9(2), 67–80. https://doi.org/10.1093/toxres/tfaa011
-
Ibis, R., Hernández. M. (2020). Métodos Alternativos en Toxicología. https://www.semanticscholar.org/paper/M%C3%A9todos-Alternativos-en-Toxicolog%C3%ADa-Ibis-Hern%C3%A1ndez/7b788be0909c4b7041f72a02f02a6ce023753e69
-
Gupta, R., Rajpoot, K., Tekade, M., Sharma, M. C., & Tekade, R. K. (2022). Methods and models for in vitro toxicity. Pharmacokinetics and Toxicokinetic Considerations, 145–174. https://doi.org/10.1016/b978-0-323-98367-9.00006-8
-
Zink, D., Chuah, J. K. C., & Ying, J. Y. (2020). Assessing Toxicity with Human Cell-Based In Vitro Methods. Trends in molecular medicine, 26(6), 570–582. https://doi.org/10.1016/j.molmed.2020.01.008
-
Marti-Figueroa, C. R., & Ashton, R. S. (2017). The case for applying tissue engineering methodologies to instruct human organoid morphogenesis. Acta biomaterialia, 54, 35–44. https://doi.org/10.1016/j.actbio.2017.03.023
-
OECD (2024), Test No. 492: Reconstructed human Cornea-like Epithelium (RhCE) test method for identifying chemicals not requiring classification and labelling for eye irritation or serious eye damage, OECD Guidelines for the Testing of Chemicals, Section 4, OECD Publishing, Paris, https://doi.org/10.1787/9789264242548-en.
-
Kretzschmar, K., & Clevers, H. (2016). Organoids: Modeling Development and the Stem Cell Niche in a Dish. Developmental cell, 38(6), 590–600. https://doi.org/10.1016/j.devcel.2016.08.014
-
Raies, A. B., & Bajic, V. B. (2016). In silico toxicology: computational methods for the prediction of chemical toxicity. Wiley Interdisciplinary Reviews: Computational Molecular Science, 6(2), 147–172. https://doi.org/10.1002/wcms.1240
-
Gozalbes, R. Vicente, Fito-López, C. (2025). Métodos computacionales en toxicología predictiva: aplicación a la reducción de ensayos con animales en el contexto de la legislación comunitaria REACH. Revista de Toxicología, 31(2), 157–167. https://dialnet.unirioja.es/servlet/dcart?info=link&codigo=4911444&orden=0
-
Santos, C. (2015). Toxicologia in silico: uma nova abordagem para análise do risco químico. Revista Intertox de Toxicologia, Risco Ambiental E Sociedade, 4(1). https://doi.org/10.22280/revintervol4ed1.66
-
Gleeson, M. P., Modi, S., Bender, A., Robinson, R. L., Kirchmair, J., Promkatkaew, M., Hannongbua, S., & Glen, R. C. (2012). The challenges involved in modeling toxicity data in silico: a review. Current pharmaceutical design, 18(9), 1266–1291. https://doi.org/10.2174/138161212799436359
-
Anadón, A., Martínez, M. A., Castellano, V., & Martínez-Larrañaga, M. R. (2013). The role of in vitro methods as alternatives to animals in toxicity testing. Expert Opinion on Drug Metabolism & Toxicology, 10(1), 67–79. https://doi.org/10.1517/17425255.2014.854329
-
Ahuja, V., Adiga Perdur, G., Aj, Z., Krishnappa, M., & Kandarova, H. (2024). In Silico Phototoxicity Prediction of Drugs and Chemicals by using Derek Nexus and QSAR Toolbox. Alternatives to laboratory animals : ATLA, 52(4), 195–204. https://doi.org/10.1177/02611929241256040
Comparte:
Copiar URL Más posts de soficamposAl enviar tus consultas o comentarios estás accediendo a recibir nuestro newsletter de forma mensual.


AGREGAR UN COMENTARIO