O futuro dos testes toxicológicos é livre de crueldade

Para alguns países esse futuro já chegou, mas o Brasil também tem muito trabalho sendo feito em prol de testes toxicológicos que não envolvem dor e sofrimento animal.
Início desta história
Em 1954, Charles Hume, fundador da Universities Federation for Animal Welfare (UFAW), propôs um levantamento de dados sobre a utilização prejudicial de animais vivos em laboratórios de investigação pura ou aplicada, ou para fins didáticos 1–3. Esse estudo revelou os números da tortura institucionalizada sofrida pelos seres senscientes[1] usados como modelos em ensino e pesquisa. A partir desse levantamento, então, organizou-se o Symposium on Humane Technique in the Laboratory, em 1957, iniciando as discussões sobre a implementação de métodos de Substituição (Replacement), Redução e Refinamento, conhecidos como princípios dos 3Rs 1–3. Esses conceitos foram criados como meio de superar experimentos desumanos.
Os 3Rs serviram de inspiração e foram popularizados em 1959, pelo zoologista William M.S. Russell e o microbiologista Rex L. Burch, a partir da publicação de seu livro ‘The Principles of Humane Experimental Technique’, onde apontam que o trato mais compassivo com os animais seria um pré-requisito para experimentos bem-sucedidos 3,4.
Os princípios de Redução e Refinamento ainda incluem animais, porém, busca-se, respectivamente, que cada teste tenha um número de animais reduzido e que eles tenham tratamentos mais dignos antes e durante os procedimentos.
Para Russel e Burch, alternativas de Substituição representavam “qualquer método científico que utilize material não senciente [...] em substituição de métodos que usem animais vertebrados vivos” 4. Em acordo com essa estratégia, incluem-se hoje os seguintes modelos:
ex vivo: uso de tecidos e órgão animais fora do corpo.
in silico: uso de softwares para análise toxicológica computacional e matemática.
in chemico: estudos físico-químicos para avaliação da toxicidade de substâncias.
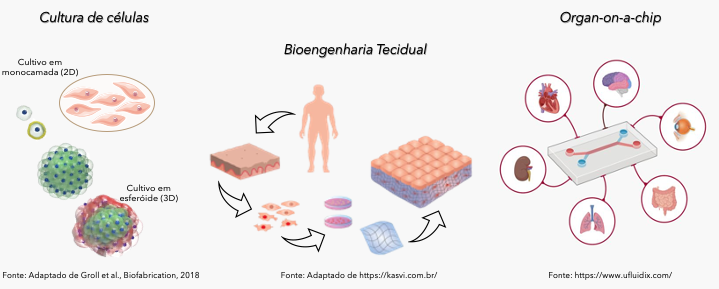
in vitro: uso de cultivo de células ou bioengenharia tecidual para estudos toxicológicos bidimensionais, 3D ou em organ-on-a-chip (um chip tridimencional com células em cultura e conexões microfluídicas, capaz de mimetizar órgãos humanos) 5.
Na foto de capa vemos um eye-on-a-chip (olho-em-um-chip) desenvolvido pelos pesquisadores Mina Massaro-Giordano, Vivian Lee, Vatinee Y. Bunya, Jeongyun Seo e Dan Huh, da Universidade da Pensilvânia. É um modelo desenvolvido para estudo de doenças oftalmológicas.
Pesquisa toxicológica no Brasil e no mundo
Os centros de pesquisa brasileiros já demonstraram interesse e compromisso com a utilização de métodos alternativos e têm caminhado em direção ao reconhecimento dos métodos internacionalmente validados e capacitação dos laboratórios comprometidos com os testes sem animais.
Esse compromisso se firmou em julho de 2012, com a criação da Rede Nacional de Métodos Alternativos (RENAMA), pelo Ministério da Ciência, Tecnologia, Inovações e Comunicações (MCTIC). Em setembro de 2012, foi criado também o Centro Brasileiro de Validação de Métodos Alternativos (BraCVAM), que é uma parceria entre o Instituto Nacional de Controle de Qualidade em Saúde (INCQS), a Fundação Oswaldo Cruz (Fiocruz) e a Agência Nacional de Vigilância Sanitária (ANVISA).
Estas foram as primeiras parcerias estabelecidas na América Latina para validar e coordenar estudos de substituição, redução e refinamento do uso de animais em testes laboratoriais para avaliação da segurança e eficácia de cosméticos, medicamentos e outras categorias de produtos às quais esses ensaios se aplicam. Atualmente, a RENAMA conta com 43 laboratórios no Brasil, especializados em diversos testes pré-clínicos e toxicológicos.
Oficialmente, no dia 3 de julho de 2014, o Conselho Nacional de Controle da Experimentação Animal (CONCEA) se posicionou claramente a favor dos testes sem animais e estabeleceu que as instituições interessadas em validar metodologias de pesquisa alternativas ao uso de animais deveriam estar associadas à RENAMA. Segundo a Resolução Normativa nº 18, em 2014 o CONCEA reconheceu o uso de 17 metodologias alternativas validadas pela Organização para a Cooperação e Desenvolvimento Econômico (OCDE), com prazo de 5 anos para implementação. Dois anos depois, através da Resolução Normativa nº 31, mais 7 métodos foram reconhecidos pelo Conselho.

Essas 24 metodologias alternativas recomendadas englobam testes que servem para avaliação dos seguintes desfechos toxicológicos:
- Corrosão ou irritação cutânea: Avaliar se uma substância tem potencial corrosivo ou irritante para a pele.
- Corrosão e irritação ocular: Avaliar se uma substância tem potencial corrosivo ou irritante para os olhos.
- Sensibilização cutânea: Mensurar ativação de células da pele e a alergenicidade das substâncias.
- Fototoxicidade: Avaliar alteração provocada pelo contato dos raios ultravioleta com uma substância química.
- Permeação cutânea: Avaliar a capacidade de substâncias atingirem a derme, porém sem atingirem vasos sanguíneos.
- Toxicidade aguda: Análise após administração ou exposição a uma única dose da substância química.
- Genotoxicidade: Avaliar se o químico possui capacidade de danificar a informação genética (DNA) de uma célula e causar mutações.
Por isso, todas as instituições envolvidas em pesquisas no Brasil foram orientadas a se adequarem a implementação de 17 metodologias alternativas até setembro de 2019. A partir de agosto de 2021, mais 7 métodos alternativos passam a ser recomendados.
Mundialmente, a indústria cosmética foi uma das primeiras a incorporar pesquisas sem animais em seus processos de avaliação. Hoje o Brasil é o 4º país que mais consome produtos cosméticos no mundo, “movimentando aproximadamente US$ 30 bilhões por ano, sendo que 15% desse total são destinados à pesquisa, ao desenvolvimento, à comunicação e ao lançamento de novos produtos” 6. Esse e outros setores industriais foram impactados no Brasil desde as resoluções do CONCEA.

Grupo Boticário desenvolve pele 3D no Brasil (Fonte: https://www.hairbrasil.com/)
No Brasil, já contamos com o trabalho de bancos de células e de empresas especializadas na comercialização de pele humana reconstruída, produzida com células extraídas a partir de doações pós cirurgias plásticas. Além disso, pesquisadores acadêmicos e industriais já possuem acesso livre aos protocolos que estão na vanguarda regulatória mundial, possibilitando a implementação de métodos alternativos cientificamente validados. As vantagens dos protocolos que substituem animais são: garantia de segurança para a saúde humana; reprodutibilidade de métodos; rapidez nos procedimentos; menor custo; compatibilidade com as regras internacionais de exportação de produtos; adequação às demandas e necessidades dos consumidores.
Cientistas de renome internacional já estão aplicando esforços, inclusive, para o desenvolvimento de tecnologias que tornem obsoleta a experimentação em animais, gerando bancos de dados confiáveis e Abordagens Integradas para Teste e Avaliação. A intenção de muitos é atingir apenas 1R, o de Replacement (ou seja, substituir totalmente os testes em animais).
Ainda existem entraves burocráticos para transferir o que há no papel para os laboratórios de todo o Brasil. Dependemos de recursos financeiros e da difusão de cursos de capacitação e treinamentos técnicos para as equipes. Atualmente, cabe a cada empresa e cada laboratório decidir e responder por si. Por isso, uma legislação federal poderia acelerar esse processo e aproximar ainda mais o nosso país da pesquisa científica do futuro.
Até a próxima!
Lorena Neves
Referências:
- Balls, M. Replacement of animal procedures: Alternatives in research, education and testing. Lab. Anim. 28, 193–211 (1994).
- Stephens, M. L., Goldberg, A. M. & Rowan, A. N. The First Forty Years of the Alternatives Approach: Refining, Reducing, and Replacing the Use of Laboratory Animals. in The state of the animals 121–135 (2001).
- Garrido, R. G., Neves, L. de O. & Dal-Cheri, B. K. de A. Regulamentação E Perspectivas Metodológicas Sobre Testes Em Animais No Brasil. Rev. Duc Altum Cad. Direito 10, 161–193 (2018).
- Russell, W. M. S. & Burch, R. L. The Principles of Humane Experimental Technique. Methuen Co., Ltd. (1959).
- Cheluvappa, R., Scowen, P. & Eri, R. Ethics of animal research in human disease remediation, its institutional teaching; and alternatives to animal experimentation. Pharmacol. Res. Perspect. 5, 1–14 (2017).
- EBERLIN, S. . et al. Métodos Alternativos para Avaliação de Segurança de Produtos no Brasil. Cosmet. e Toilet. 31, 20–23 (2019).
[1] Capacidade de experimentar experiências positivas e/ou negativas, possuindo emoções e estado de primeira pessoa.
Compartilhe:
Copiar URL Mais postagens de lorenaAo enviar suas perguntas ou comentários, você concorda em receber nossa newsletter mensalmente.



ADICIONAR UM COMENTÁRIO